Imuno-histoquímica no câncer de mama
Após o diagnóstico de câncer de mama, que é feito a partir da análise microscópica das células do tumor obtidas na biópsia da mama (exame anátomo-patológico), precisamos complementar o diagnóstico avaliando a “biologia” do tumor, ou seja, quais receptores estão presentes ou não nas células malignas. Os receptores funcionam como “portas de entrada” que recebem estímulos para as células malignas crescerem. Eles são avaliados através da realização de um exame chamado imuno-histoquímica.
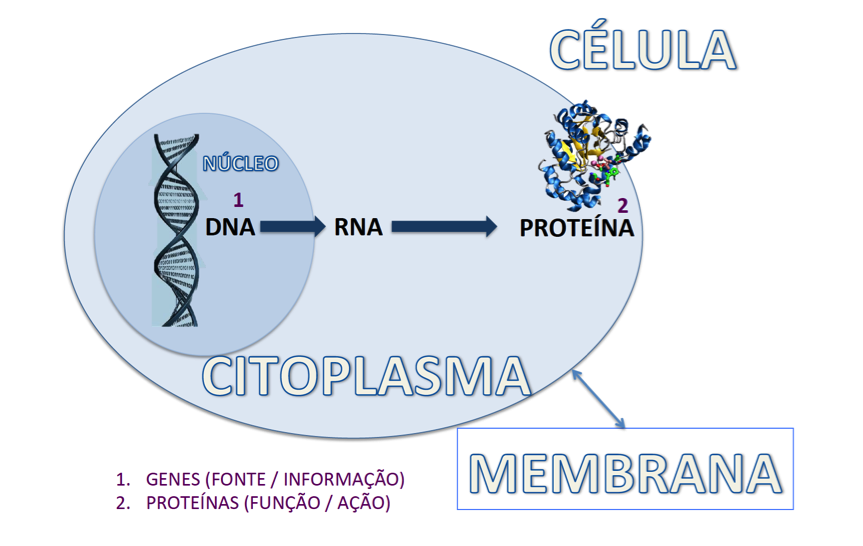
Imuno-histoquímica é a junção de duas áreas: histologia e imunologia, com a finalidade de diagnóstico. É uma forma de avaliação de proteínas, identificando a sua presença ou quantidade, em uma amostra de algum órgão, obtida por biópsia ou retirada cirúrgica de alguma doença (figura 1). As proteínas são responsáveis por exercer “tarefas” nas células; elas têm a função determinada pelo código existente nos genes.Por exemplo, as proteínas podem estimular uma célula a se diferenciar a fazer uma função específica, ou se multiplicar e formar mais células.
Figura 1 – Representação gráfica de uma célula.
Classicamente, se utiliza a morfologia (estudo da forma) da células ao microscópio para se estudar doenças como o câncer. Em semelhança, a imuno-histoquímica é um método de estudo em um corte histológico (material preparado para exame no microscópio óptico; figura 2).
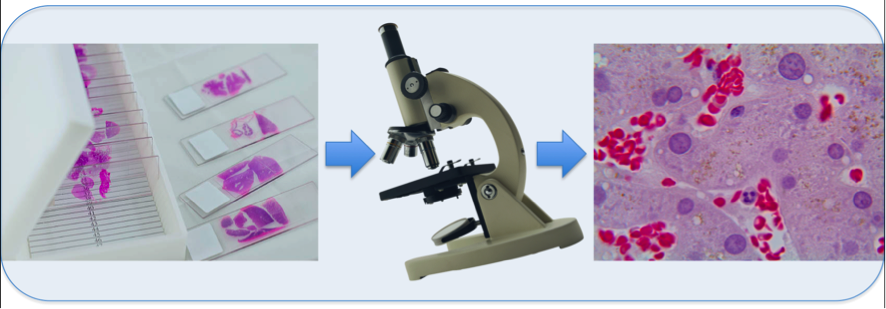
Figura 2 – Após a retirada de material de um tumor, ele é colocado em parafina para conservação e, após, são feitos cortes que são colocados em lâminas e, após corados, são visualizados ao microscópio.
Embora a morfologia seja uma excelente ferramenta, há dados importantes que permitem detectar diferenças essenciais entre diferentes tipos de tumores mas que não se manifestam pela forma, logo, a imuno-histoquímica é uma ótima técnica complementar. A grande vantagem da imuno-histoquímica é a possibilidade de avaliar a expressão proteica simultaneamente com o exame da forma das células e tecidos, o que permite que se saiba exatamente onde se está fazendo a análise, se é em uma célula doente (e com que doença) ou normal.
Este tipo de exame tem múltiplas funções, desde o auxílio a identificar a presença ou ausência de determinada doença, passando por classificação ou determinação de subgrupos dentro de uma doença específica e chegando a identificação de fatores prognósticos e preditivos. Um fator prognóstico é um dado que auxilia na previsão de como será o comportamento biológico da doença (por exemplo, se sua história natural é mais ou menos agressiva). Um fator preditivo é um dado que auxilia a prever a resposta a determinado tratamento.
No contexto do câncer de mama, é através da imuno-histoquímica que, na prática, se pesquisam os seguintes marcadores prognósticos e/ou preditivos:
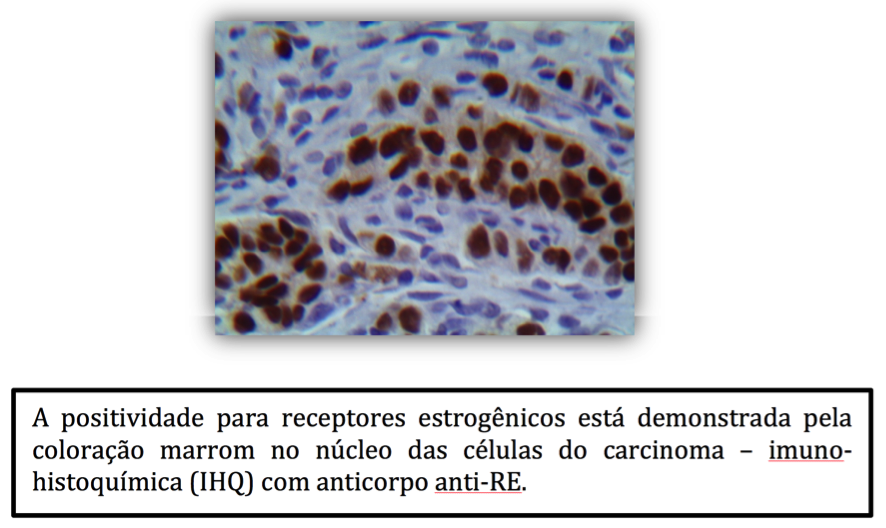
1) Receptores hormonais (RH):para avaliar a eficácia do tratamento com antagonistas do hormônio estrogênio, é preciso saber se o câncer expressa o receptor para esta proteína (RE) no seu núcleo celular e em que quantidade. Também se faz a pesquisa de receptores para progesterona (RP; figura 3). Sabe-se também que os cânceres de mama que expressam RE tendem a ser biologicamente menos agressivos na sua história natural. RE é expresso em cerca de 80% dos carcinomas mamários, variando de 1-100% das células da doença. Muitos estudos clínicos randomizados têm demonstrado que o RE é um fator preditivo importante para a resposta à “terapia hormonal” tal como o tamoxifeno, que atua bloqueando o crescimento celular estimulado pelo estrógeno, através da ligação aos RE. A resposta clínica a tratamento com inibidores da aromatase, que inibem a produção de estrógeno, também é dependente da análise do RE, visto que apenas neoplasias positivas irão responder à terapia.
Figura 3 – Imuno-histoquímica para receptores de estrogênio.
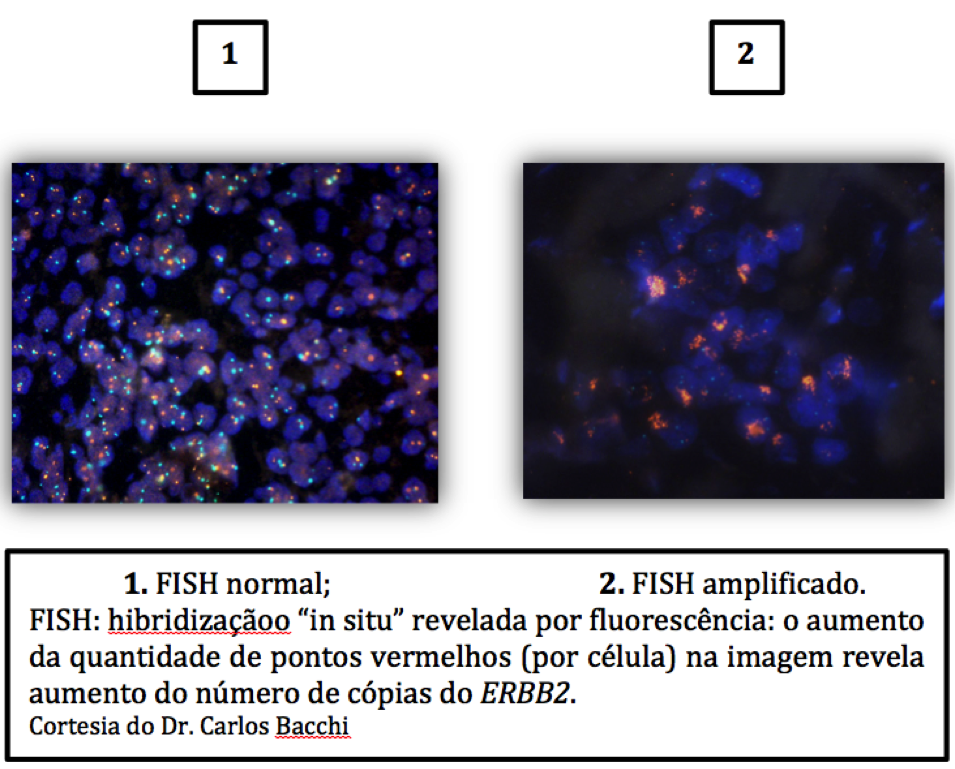
2) c-Erb-B2 ou Her2 ou Her2-neu: esta é uma proteína que situa-se na superfície da célula e que em certos tipos de câncer de mama encontra-se “aumentada” (diz-se superexpressa; figura 4). Nos tumores com esta característica, há uma tendência a crescimento mais rápido, contudo em boa parte dependente da ativação desta proteína (Her2). A avaliação desta é um fator preditivo ao tratamento com anticorpos que bloqueiam a sua ação, assim como inibidores do sinal que a mesma produz no interior da célula para sua multiplicação. Importante saber que em alguns casos, quando a expressão é intermediária (a saber, escore 2+), deve-se complementar o estudo com outra técnica chamada de ISH (hibridização “in situ”; figura 5) para avaliar se o gene que codifica a proteína está amplificado (o mecanismo de aumento da quantidade da proteína, quando ocorre, é um aumento no número de cópias do gene da Her2, uma espécie de mutação).
Figura 4 – Imuno-histoquímica para Her2.
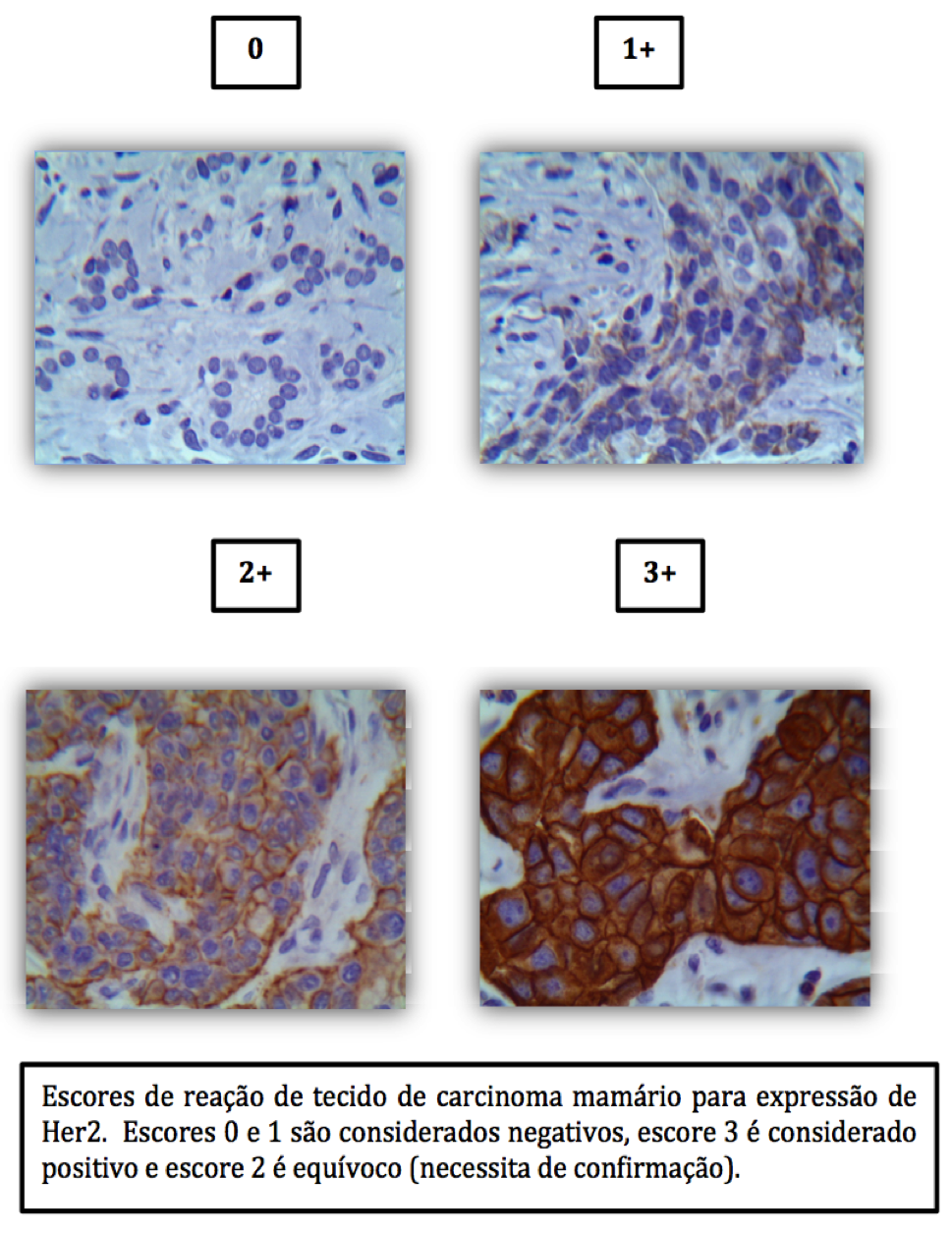
Figura 5 – Hibridização “in situ” para Her2.
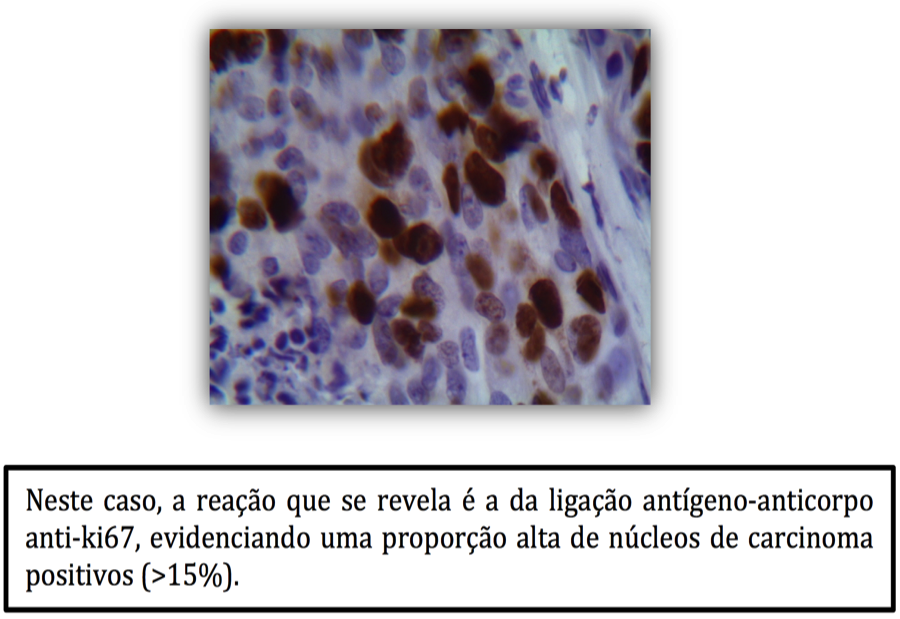
3) Ki67: é um marcador que auxilia a determinar se aquele câncer é um tumor de crescimento mais rápido ou mais lento, podendo auxiliar na definição do prognóstico, em alguns casos. Diz-se que tumores expressando ki67 por imuno-histoquímica (figura 6)em proporção igual ou menor do que 10% são indolentes (crescimento lento) e que os que expressam acima de 30% seriam os mais agressivos. A faixa entre 10-30% é duvidosa e em algumas situações é recomendável teste genético para melhor classificação.
Figura 6 – Imuno-histoquímica para Ki67.
Além destas, existem outras proteínas que podem ser pesquisadas e que auxiliam no manejo da doença em alguns contextos clínicos específicos:
4) e-Caderina: proteína relacionada com a adesão normal de uma célula em outra. Pode não estar funcionante (na maioria das vezes ausente) em um tipo de câncer que se chama “carcinoma lobular” e que se caracteriza entre outras coisas por um padrão de espalhamento que é difícil de identificar na cirurgia ou na radiologia, dificultando a determinação do tamanho ou da extensão do tumor (bem como da remoção cirúrgica);
5) p120: proteína com função análoga a e-Caderina e utilizada com o mesmo propósito no exame de imuno-histoquímica;
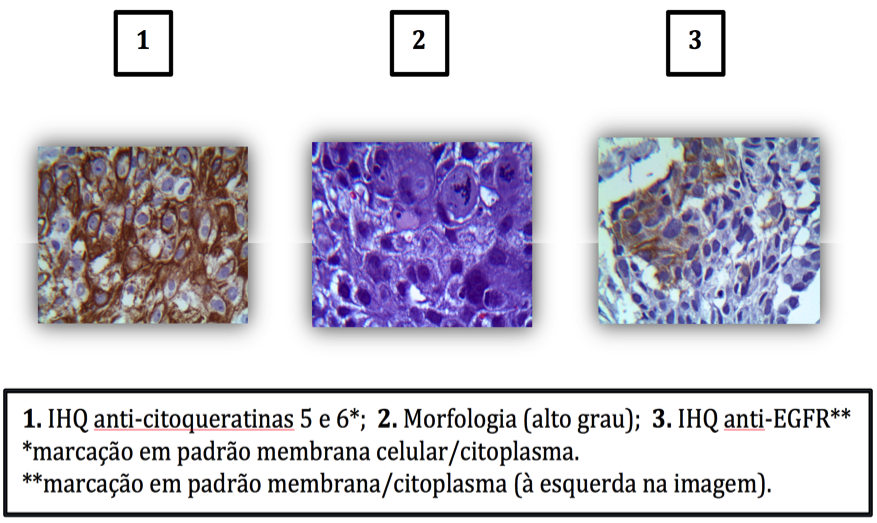
6) Citoqueratinas 5/6 (“esqueleto celular”), EGFR (receptor de fator de crescimento epitelial): auxiliam na classificação dos casos que não expressam nem RH, nem Her2. Estes casos são conhecidos como carcinomas “triplo negativos”, ou seja, negativos para RE, RP e Her2. Alguns destes são de “fenótipo basal-símile”, ou seja com características semelhantes às células de reserva (um tipo de célula tronco) da mama (figura 7). Estes tumores costumam ser agressivos, mas bastante sensíveis à quimioterapia.
Figura 7 – Imuno-histoquímica para CK5 e 6 e para EGFR.
7) Calponina, p63, actina: são proteínas que estão presentes em uma camada do epitélio da mama que se chama mioepitélio. Estas células, quando presentes, indicam que o câncer ainda não é invasor (chama-se este de carcinoma “in situ”). O carcinoma “in situ” não tem potencial de disseminação para fora da mama. Há ainda diversas lesões benignas que podem simular um carcinoma mamário invasivo como cicatriz radial, adenose esclerosante, adenose nodular (tumor adenosis), etc. Assim, a identificação imuno-histoquímica inequívoca da presença de células mioepiteliais se tornou fundamental.
Em resumo, qualquer proteína que possa qualitativamente ou quantitativamente ser pesquisada com o intuito de fornecer informação diagnóstica, prognóstica ou preditiva, pode ser pesquisada por imuno-histoquímica.
E por que apenas proteínas e não outros componentes celulares?
Porque nossos anticorpos (nosso sistema imunológico) são direcionados majoritariamente para ligação com proteínas para o combate às diferentes formas de agressão que nosso corpo recebe. Isto porque os microorganismos são na sua maioria revestidos por proteínas específicas.
Na técnica de imuno-histoquímica é essencial que se desenvolvam em laboratório anticorpos contra as proteínas que se pretende estudar nas doenças, como se fosse uma imitação do que faz o nosso sistema imunológico.
Contudo, não se deve confundir a imuno-histoquímica com imunoterapia, a primeira é uma ferramenta diagnóstica e a segunda (que não é tema deste texto) é uma forma promissora de tratamento.
E como os anticorpos identificam as proteínas que queremos aferir?
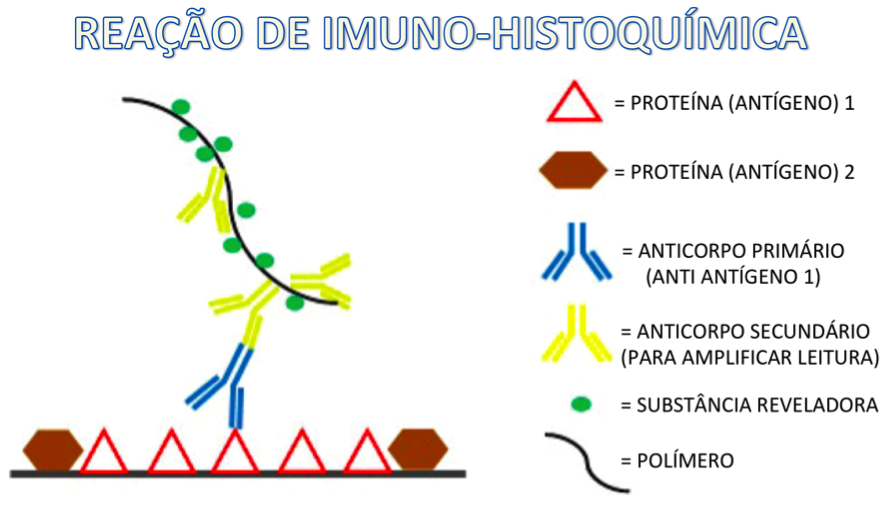
Primeiramente, anticorpos são moléculas que se ligam com boa especificidade às proteínas contra as quais foram criados (antígenos). Por exemplo, se temos anticorpos contra determinado vírus, estes valem quase que exclusivamente para este tipo de microorganismo. O mesmo conceito se aplica à técnica de imuno-histoquímica (figura 8).
E como fazemos para identificar se o anticorpo aplicado em um tecido em estudo “encontrou” o seu antígeno (ou proteína-alvo)?
Também se criou uma tecnologia de marcação destes anticorpos (por exemplo, anticorpos anti-RE, anti-ki67, anti-Her2, etc) com cores ou pigmentos, permitindo assim a sua visualização e a sua localização nas células, tecidos ou partes de células no microscópio.
Figura 8 – Técnica de imuno-histoquímica.
Assim, em todos os casos com diagnóstico de câncer de mama, é essencial a avaliação por método de imuno-histoquímica para melhor conhecer a biologia de cada tumor, bem como escolher a melhor forma de tratamento e acompanhamento da(o) paciente.

Guilherme Portela Coelho
Médico Patologista
Caxias, RS
Referências
- Dewar R, Fadare O, Gilmore H, Gown AM. Best practices in diagnostic immunohistochemistry: myoepithelial markers in breast pathology. Arch Pathol Lab Med 2011 Apr;135:422-9.
- Zhao L, Yang X, Khan A, Kandil D. Diagnostic role of immunohistochemistry in the evaluation of breast pathology specimens. Arch Pathol Lab Med 2014 Jan; 138:16-24.
- Bal O, Yalcintas Arslan U, Durnali A et al. Progesterone receptor status in determining the prognosis of estrogen receptor positive/ HER2 negative breastcarcinoma patients. J BUON. 2015;20:28-34.
- Calhoun BC, Collins LC. Predictive markers in breast cancer: An update on ER and HER2 testing and reporting. Semin Diagn Pathol. 2015;32:362-9.
- Hammond ME, Hayes DF, Dowsett M et al. American Society of Clinical Oncology; College of American Pathologists. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer(unabridged version). Arch Pathol Lab Med 2010;134:e48-72.
- Yaziji H, Taylor CR, Goldstein NS et al. Members of the Standardization Ad-Hoc Consensus Committee. Consensus recommendations on estrogen receptor testing in breast cancer by immunohistochemistry. Appl Immunohistochem Mol Morphol 2008;16:513-20.
- Wolff AC, Hammond ME, Schwartz JN, et al. American Society of Clinical Oncology/College of American Pathologists.American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer. Arch Pathol Lab Med 2007;131:18-43.
- Wolff AC, Hammond ME, Hicks DG, Dowsett M, et al. American Society of Clinical Oncology.; College of American Pathologists. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update. Arch Pathol Lab Med 2014;138:241-56.
- Ng CK, Martelotto LG, Gauthier A, et al. Intra-tumor genetic heterogeneity and alternative driver genetic alterations in breast cancers with heterogeneous HER2 gene amplification. Genome Biol 2015 May 22;16:107.
- Dowsett M, Nielsen TO, A’Hern R, et al. International Ki-67 in Breast Cancer Working Group. Assessment of Ki67 in breast cancer: recommendations from the International Ki67 in Breast Cancer working group. J Natl Cancer Inst 2011;103:1656-64.
- Polley MY, Leung SC, McShane LM, et al. An international Ki67 reproducibility study. International Ki67 in Breast Cancer Working Group of the Breast International Group and North American Breast Cancer Group. J Natl Cancer Inst 2013;105:1897-906.
- Polley MY, Leung SC, Gao D, et al. An international study to increase concordance in Ki67 scoring. Mod Pathol. 2015 Jun;28(6):778-86.
- Penault-Llorca F, Radosevic-Robin N. Pathology. Ki67 assessment in breast cancer: an update. 2017;49:166-171.

